10月19日晚間,云頂新耀官方公眾號(hào)宣布,其合作伙伴Providence公司的mRNA新冠候選疫苗PTX-COVID19-B在評(píng)估其安全性、耐受性和免疫原性的Ⅱ期研究中取得了積極頂線結(jié)果。
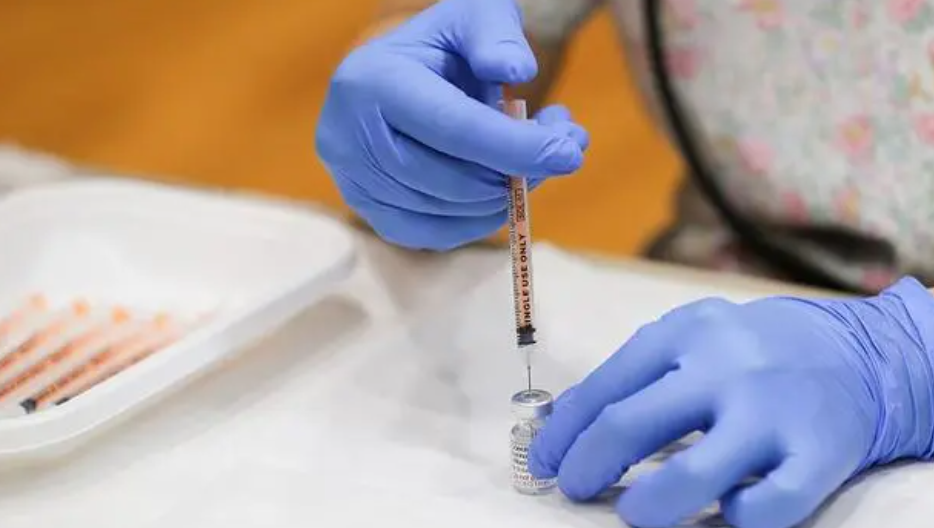
具體而言,PTX-COVID19-B是一款mRNA候選疫苗,可誘導(dǎo)產(chǎn)生針對(duì)新冠刺突蛋白的強(qiáng)效中和抗體
云頂新耀公眾號(hào)介紹
試驗(yàn)結(jié)果顯示,兩組在接種了第一劑和第二劑疫苗后的征集性全因不良事件(AE)總體發(fā)生率相似:PTX-COVID19-B分別為71.6%和59.0%,輝瑞/百歐恩泰的mRNA疫苗分別為74.2%和62.4%。兩組均無與接種相關(guān)的非征集性嚴(yán)重不良事件(SAE)的報(bào)告。
在第一劑和第二劑接種后,PTX-COVID19-B的局部征集性不良事件分別為62.6%和53.8%, 輝瑞/百歐恩泰的mRNA疫苗分別為65.1%和57.1%;PTX-COVID19-B全身性征集性不良事件分別為49.7%和36.9%,輝瑞/百歐恩泰的mRNA疫苗分別為58.6%和 45.3%。PTX-COVID19-B組受試者報(bào)告非征集性不良事件的比例也與輝瑞/百歐恩泰的mRNA疫苗組相似(53.7%和52.4%)。
免疫原性分析表明,接種兩劑PTX-COVID19-B疫苗兩周后產(chǎn)生的中和抗體滴度GMT與輝瑞/百歐恩泰的mRNA疫苗相比達(dá)到統(tǒng)計(jì)學(xué)非劣效(0.84,95%可信區(qū)間:0.69-1.02)。接種第二劑兩周后的分析也表明血清應(yīng)答率同樣具有非劣效。
在血清學(xué)證實(shí)無既往感染或接種疫苗的人群中進(jìn)行了一項(xiàng)重要的亞組分析,PTX-COVID19-B在第二劑疫苗接種兩周后誘導(dǎo)的免疫應(yīng)答非劣效于輝瑞/百歐恩泰的mRNA疫苗(GMR 1.23,95%可信區(qū)間:0.95-1.58)。
基于此,云頂新耀正在提交與合作伙伴聯(lián)合開展的III期臨床試驗(yàn) (IND) 申請(qǐng),以評(píng)估PTX-COVID19-B作為加強(qiáng)針的安全性和免疫原性。公司還計(jì)劃于今年下半年在中國和其他云頂新耀授權(quán)區(qū)域針對(duì)奧密克戎(Omicron)的二價(jià)加強(qiáng)針候選疫苗EVER-COVID19-M1.2提交臨床試驗(yàn)申請(qǐng)。
云頂新耀還表示,雖然PTX-COVID19-B針對(duì)的是新冠病毒的原始毒株,但其可為針對(duì)當(dāng)前及今后新冠變異毒株和其他β-冠狀病毒的多價(jià)疫苗開發(fā)做準(zhǔn)備。
云頂新耀與Providence 公司的這項(xiàng)合作起始于一年前。2021年9月,云頂新耀與Providence(全稱Providence Therapeutics Holdings Inc.)簽訂戰(zhàn)略合作協(xié)議,以共同推進(jìn)mRNA疫苗及療法的研發(fā)
在同一時(shí)間,云頂新耀還與Providence達(dá)成了一項(xiàng)全球合作
盡管如此,在公告mRNA新冠候選疫苗候選進(jìn)展后
年內(nèi)8月16日,云頂新耀公告將以4.55億美元價(jià)格退回Trop-2抗體藥物偶聯(lián)物(ADC)戈沙妥珠單抗在大中華區(qū)、韓國和部分東南亞國家的開發(fā)和商業(yè)化獨(dú)家權(quán)利給Immunomedics
戈沙妥珠單抗一直是云頂新耀的核心品種
今年6月
關(guān)于云頂新耀的這項(xiàng)舉動(dòng)
在2021年歐洲腫瘤內(nèi)科學(xué)會(huì)(ESMO)乳腺癌大會(huì)上,DS-1062治療三陰乳腺癌的Ⅰ期臨床療效和安全性數(shù)據(jù)均十分優(yōu)異
并且
另一方面,行業(yè)寒冬之下
財(cái)務(wù)數(shù)據(jù)方面,2021年
值得注意的是
最近更新
熱點(diǎn)聚焦


 【山東媒體邀約】2023山東醫(yī)療器械展|2023第49屆中國國際醫(yī)療器械(山東)博覽會(huì)|cmee醫(yī)博會(huì)
【山東媒體邀約】2023山東醫(yī)療器械展|2023第49屆中國國際醫(yī)療器械(山東)博覽會(huì)|cmee醫(yī)博會(huì)  ITS Asia 2023第十六屆中國國際智能交通展覽會(huì)
ITS Asia 2023第十六屆中國國際智能交通展覽會(huì)  【北京媒體邀約】2023年世界機(jī)器人大會(huì)將于北京舉辦
【北京媒體邀約】2023年世界機(jī)器人大會(huì)將于北京舉辦 
 【上海媒體邀約】2023中國(上海)化工裝備展覽會(huì)-化工展位預(yù)定
【上海媒體邀約】2023中國(上海)化工裝備展覽會(huì)-化工展位預(yù)定  【上海媒體邀請(qǐng)】2023動(dòng)漫IP授權(quán)展覽會(huì)及上海品牌授權(quán)展
【上海媒體邀請(qǐng)】2023動(dòng)漫IP授權(quán)展覽會(huì)及上海品牌授權(quán)展 贊助商廣告

 !">
!">




 13501698868
13501698868





